Laktobazillen dominieren zu über 70% das humane vaginale Mikrobiom.
von Gerhard Ernst Steyer
Das humane vaginale Mikrobiom ist einzigartig. Es wird von Laktobazillen zu über 70 % dominiert und unterliegt hormonbedingt während des Lebens erheblichen Schwankungen. Bei bakterieller Vaginose entsteht begünstigt z. B. durch Gardnerella vaginalis ein schädlicher Biofilm, der auch durch Antibiotikaeinsatz meist nicht ganz zu beseitigen ist und chronisch-rezidivierend auftritt (Rezidivrate bis zu 50 % in 6–12 Monaten). Antibiotikagaben, die oft aus anderen Gründen erfolgen, können sogar eine vaginale Dysbiose verursachen. Mit oral verabreichten Probiotika (z. B. einer multi-strain Kombination aus L. crispatus, L. gasseri, L. jensenii und L. rhamnosus) gelingt es, den Biofilm aufzubrechen und die vaginale Mikrobiota wieder zu regenerieren.
Inhalt
Das humane vaginale Mikrobiom ist einzigartig
Veränderungen des vaginalen Mikrobioms im Laufe des Lebens
Schützen und Regenerieren mit Probiotika bei bakterieller Vaginose und vaginaler Dysbiose
Obwohl Laktobazillen in der Umwelt omnipräsent vorkommen, bewohnen sie nur drei Regionen des menschlichen Körpers: die Mündhöhle, den Darm und die Vagina. Alle drei Regionen besitzen eine Schleimhaut, die allerdings deutlich unterschiedlich aufgebaut ist. In der gesunden Vagina bilden Laktobazillen ein Ökosystem mit dem Wirtskörper zum gegenseitigen Nutzen. Von den weit über 100 bisher bekannten Laktobazillus-Strains werden in der Scheide vier Strains als dominante Mitglieder der vaginalen Mikrobiota gefunden, nämlich L. crispatus, L. gasseri, L. jensenii und L. iners [39], häufig wird auch L. rhamnosus festgestellt [20,] [42]. Abhängig von der ethnischen Zugehörigkeit bestehen bei der Dominanz in der Scheide deutliche Unterschiede [34]. Dieses Ökosystem entsteht und bleibt so erhalten, weil die dominanten Laktobazillen besondere Fähigkeiten besitzen: z. B. können sie bei der Nutzung der Ressourcen [Abb.1] im Wettbewerb mit anderen Bakterienarten gewinnen oder sie verdrängen nicht ansässige Spezies durch ihre Fähigkeit zur Produktion antimikrobieller Substanzen, außerdem können sie durch Senkung des pH-Wertes eine für potenziell pathogene Keime unwirtliche Umgebung schaffen.
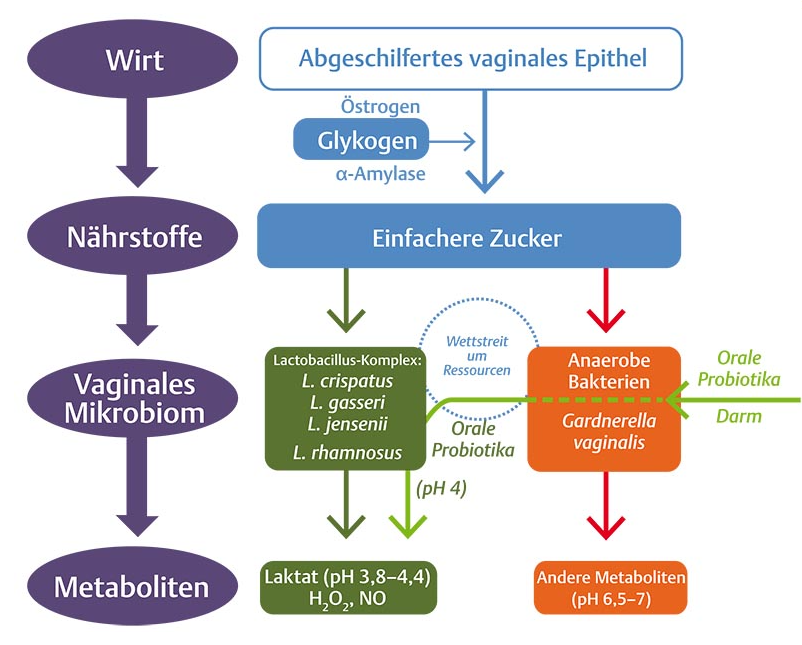
Abb. 1 Nutzung der Ressourcen durch die vaginale Mikrobiota (mod. n. [34]).Östrogen stimuliert die Produktion und Anhäufung von Glykogen (abgeschilferte Epithelzellen in der Scheide), das von humaner a-Amylase zu einfacheren Zuckern abgebaut wird. Diese Zucker werden von Laktobazillen anaerob fermentiert, die das Endprodukt Laktat an die Umgebung abgeben und damit den pH-Wert in der Scheide senken. Zudem sezernieren sie H2O2 sezernieren, das seine bakterizide Wirkung entfalten kann. Im Wettstreit um Ressourcen können auch andere anaerobe Bakterien überwuchern und einen weniger sauren pH-Wert verursachen, dabei hilft z. B. Gardnerella vaginalis durch die Bildung eines Biofilms. Dieser Biofilm wird von anaeroben Bakterien besiedelt, er kann sich in dieser Umgebung leicht weiter ausdehnen. Antibiotika bringen nur kurzzeitige Erfolge bis wieder Rezidive auftreten, aber mit der Zufuhr ausgewählter probiotischer Laktobazillen kann der pH-Wert wieder in den sauren Bereich gebracht werden. Durch die Aufbrechung des Biofilms erfolgt eine nachhaltige Sanierung. Bei oraler Zufuhr der Laktobazillen bilden diese ein natürliches Reservoir im Darm für die Wiederbesiedlung der Vagina [7,] [36].
Gelingt dies nur mangelhaft, wie bspw. nach einer Antibiotikatherapie [Abb. 2], entsteht eine bakterielle Vaginose (BV): Diese ist charakterisiert durch den Wechsel von einer Laktobazillen-dominierten hin zu einer anaeroben Mikrobiota mit einer Dominanz an fakultativen Bakterien [31].
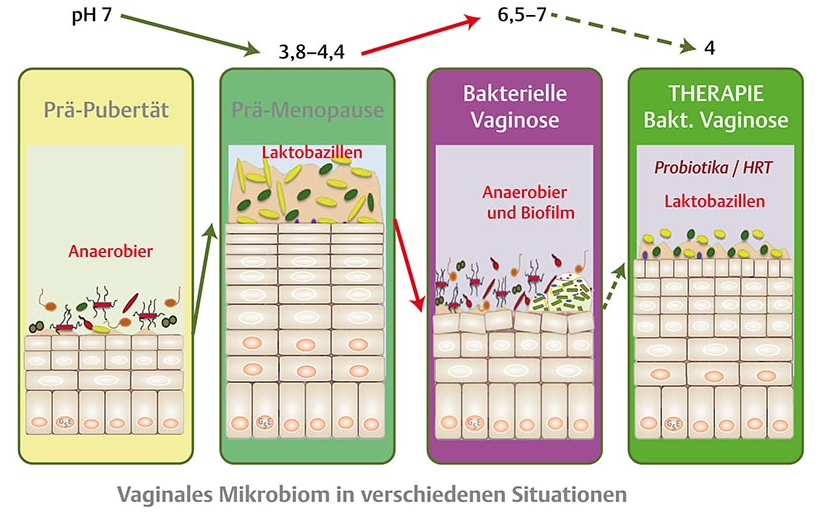
Abb. 2 Veränderungen des vaginalen Mikrobioms und Epithels im Laufe des Lebens erfolgen hormonabhängig. Schutz und Regeneration durch Probiotika kann durch die orale Zufuhr des Laktobazillus-Komplexes erfolgen. (mod. n. [30,] [39]).a) Wenig Östrogen bewirkt bis zur Pubertät geringe Glykogen-Bereitstellung und hohe Diversität der vaginalen Mikrobiota mit hohem pH-Wert auf einem dünnen, wenig schleimbedeckten Epithel.b) Von der Pubertät bis zur Menopause steht durch höhere Östrogenspiegel mehr freies Glykogen für die Laktobazillen zur Verfügung, die auf einem vielschichtigen, mit einer dicken Mukusschicht bedeckten vaginalen Epithel zur dominierenden Spezies in der gesunden Vagina werden.c) Antibiotikagaben bzw. der sinkende Östrogenspiegel nach der Menopause bewirken eine atrophe, trockene glykogenärmere Epithelschicht, die mit steigendem pH-Wert von anderen, hauptsächlich anaeroben Bakterien besiedelt wird; bei der bakteriellen Vaginose bilden Gardnerella vaginalis einen Biofilm der auch nach Metronidazol-Anwendung chronisch rezidivierend wird.d) Durch orale Zufuhr des Laktobazillus-Komplexes mit Probiotika wird im Rektum hingegen ein Reservoir für die verlorengegangenen Laktobazillen gebildet, die dann wieder die Vagina besiedeln, den pH-Wert wieder in den sauren Bereich verschieben und den Biofilm aufbrechen können.
Eine BV ist wiederum assoziiert (das bedeutet nicht automatisch, verursachend beteiligt) bei einer Vielzahl von Problemen [43] wie z. B. einer hohen Rate postoperativer Infektionen oder einem 1,6-fachen Anstieg einer HIV-Infektion [1,] [19], beim Auftreten während der Schwangerschaft mit dem erhöhten Risiko einer Früh- bzw. Fehlgeburt, geringem Geburtsgewicht oder gesteigerter Sterblichkeit der Neugeborenen [22]. Die Zufuhr der dominanten Laktobazillen L. crispatus, L. gasseri, und L. jensenii sowie L. rhamnosus auf oralem Weg ermöglicht die Bildung eines natürlichen Reservoirs im Darm für die Besiedlung der Scheide [20], sowohl präventiv als auch regenerativ. L. iners eignet sich nicht als probiotisches Bakterium, wird zwar häufig in der Scheide gefunden, aber sowohl bei Gesunden als auch bei Dysbiose, ist mit Frühgeburt assoziiert [38] und hat eine geringe Genomgröße, die auf ein symbiotisches bzw. parasitäres Verhalten hinweist [40].
Das humane vaginale Mikrobiom ist einzigartig
Laktobazillen werden von den vaginalen Epithelzellen toleriert [53] und hemmen die Induktion proinflammatorischer Zytokine. Das kommt auch in der Bezeichnung „Vaginose“ zum Ausdruck, denn für eine Vaginitis fehlt die lokale Inflammation. Gerade diese Fähigkeit der dominanten Laktobazillen, eine Infektion zu hemmen ohne Entzündung zu induzieren maximiert die Fruchtbarkeit und die erfolgreiche Beendigung einer Schwangerschaft! Dieser „Schutz der reproduktiven Phase“ [28] schließt auch das hohe Infektionsrisiko, das mit der Schwangerschaft verbunden ist, mit ein.
Einzigartig ist das vaginale Mikrobiom beim Menschen in Bezug auf die Dominanz an Laktobazillen von über 70 %; bei Säugetieren haben die Laktobazillen hingegen nach derzeitigem Erkenntnisstand nur einen Anteil von weniger als 1 % an der gesamten vaginalen Mikrobiota. Dementsprechend ist der niedrige vaginale pH-Wert mit 4,5 typisch für Menschen, bei Säugetieren schwankt der pH-Wert zwischen 5,4 und 7,8. Allerdings reihen sich beim Menschen 28-tägige Zyklen kontinuierlich von der Menarche bis zur Menopause aneinander. Aber auch innerhalb jedes Ovulationszyklusses ändern sich zusätzlich hormonbedingt die Werte und der pH ist knapp vor dem Eisprung am niedrigsten, weil dann die Zahl an Laktobazillen am höchsten ist.
Warum Laktobazillen?
Durch die Produktion von Laktat hemmen diese Laktobazillen das Wachstum vieler anderer Bakterien und ermöglichen durch die Schaffung eines sauren Milieus (pH-Wert zwischen 3,8 und 4,4) [48] die Bildung von Stickstoffmonoxid, welches bakterizid wirkt. Den Zusammenhang zwischen Laktobazillen und dem Säuregehalt hat schon 1892 der deutsche Gynäkologe Albert Döderlein erkannt und in seiner Habilitationsschrift ausführlich auf die Stäbchen (= Bakterien) im Scheidensekret hingewiesen, die er von gesunden Schwangeren untersucht hat und die später nach ihm benannt worden sind [5]. Dieser Laktobazillus-Komplex [6] dominiert die vaginale Mikrobiota im reproduktionsfähigen Alter. Eine ausreichende Zahl von Laktobazillen in der Scheide verhindert durch die Sezernierung von H2O2 eine Überwucherung und die Bildung eines Biofilms z. B. durch Gardnerella vaginalis, Atopobium vaginae, Prevotella, Megasphaera oder bestimmten Clostridien (bekannt als BV-assoziierte Bakterien 1-3) sowie Mycoplasma hominis [4].
Laktat blockiert Histon-Deacetylasen (HDACs) und steigert dadurch Gentranskription und DNA-Reparatur. Laktat induziert auch Autophagocytose / Autophagie (für seine Arbeiten zu diesem Thema erhielt der Japaner Ösumi 2016 den Nobelpreis für Medizin oder Physiologie) in Epithelzellen der Vagina um intrazelluläre Mikroorganismen abzubauen und so eine Homöostase zu unterstützen. Die Abschilferung von Epithelzellen ist ein bewährter Mechanismus um die auf der Körperoberfläche aufgelagerten Mikroorganismen zu entfernen und stellt damit eine erste Verteidigungslinie gegen Infektionen dar. Das Vagina-adaptierte Actinobacterium Gardnerella vaginalis setzt ein Toxin frei (Vaginolysin), das ihm seine Anhaftung an Epithelzellen erleichtert und das wiederum ermöglicht die Bildung eines lichtmikroskopisch sichtbaren Biofilms (Clue-Zellen), der sehr widerstandsfähig gegen Verteidigungsmechanismen des Körpers, aber auch gegen eingesetzte Antibiotika wie Metronidazol ist [25]. Die genannten Laktobazillen (nämlich L. crispatus, L. gasseri, L. jensenii und L. rhamnosus) können diesen Biofilm aber aufbrechen – und sie können als Probiotikum oral zugeführt werden [20]. L. iners hingegen codiert Inerolysin, ein porenbildendes Toxin, ähnlich dem bereits erwähnten Vaginolysin von Gardnerella vaginalis [40].
Veränderungen des vaginalen Mikrobioms im Laufe des Lebens
Im Laufe des Lebens unterliegt die vaginale Mikrobiota signifikanten strukturellen Veränderungen, die verknüpft sind einerseits mit den sich ändernden Östrogenspiegeln von der Pubertät bis hin zur Menopause [10] und andererseits mit dem Immunsystem und dessen hormonabhängigem Funktionswechsel im Monatszyklus der Frau oder während der Schwangerschaft.
Die initiale Besiedlung der Vagina erfolgt bei der Passage durch den Geburtskanal, wo ein Kontakt mit der mütterlichen vaginalen Mikrobiota stattfindet. Damit bei der Sectio nicht die Hautbakterien (die Haut ist kein Habitat für Laktobazillen; s. o.) des Klinikpersonals und der Mutter das Rennen bei der Besiedlung machen, wird ein Vaginal-Seeding [8] diskutiert, bei dem die frisch entbundenen Babys mit dem gesammelten Scheidensekret ihrer Mutter (auf Haut und Mund) eingerieben werden. Damit soll das Immunsystem moduliert und dem Entstehen von Asthma, Allergien und Atopien vorgebeugt werden, denn Kinder, die mit Kaiserschnitt auf die Welt gebracht werden, haben ein wesentlich höheres Risiko, später atopische Erkrankungen zu entwickeln. Die so eingeriebenen Babys zeigten nach 30 Tagen ein Mikrobiom, das der natürlichen Geburt ähnlicher war als dem anderer Kaiserschnittkinder aus der Kontrollgruppe. Es gibt wegen einer möglichen Ansteckungsgefahr des Babys aber auch warnende Stimmen.
Eine geprüfte Möglichkeit, atopischen Erkrankungen durch Modulation des Immunsystems entgegenzuwirken, bietet der gezielte Einsatz probiotischer Bakterien [32]. In der PandA-Studie erhielten Hochrisikobabys probiotische Bakterien, die über die Fähigkeit verfügen [33], IL10 zu induzieren und IL5 sowie IL13 zu hemmen. Dadurch kann die physiologische Th2-Dominanz des Immunsystems nach der Geburt signifikant moduliert werden und eine Balance zwischen Th1- und Th2-Zellen erreicht werden. Dendritische Zellen des Immunsystems können im Körper wandern [54] und holen über ihre Fortsätze sogar aus dem Darm der Mutter Bakterien ab; diese transportieren sie dann über die Lymphwege bis zur Brustdrüse (entero-mammary pathway [44]), wo sie der Muttermilch beigefügt werden. Dadurch erreichen beim Säugen Bakterien aus dem Darm der Mutter die nächste Generation. Das kann aber natürlich nur mit Bakterien erfolgen, die im mütterlichen Darm vorhanden sind, der Verlust konservierter Mikrobiota in einer Generation (z. B. durch Antibiotikatherapien) führt zum Verlust der nötigen Diversität bei der nächsten Generation [2]. Daher ist es so wichtig, bei Behandlungen mit Antibiotika die dadurch (als Nebenwirkung) verursachten Schäden an der Mikrobiota und am Darmepithel selbst (!) durch die Zufuhr probiotischer Bakterien zu beseitigen.
Die durch Antibiotikatherapien verursachten Schäden sind z. B.:
der Verlust von Leitkeimstämmen,
Veränderungen der metabolischen Kapazität oder
Überwucherung von pathogenen Bakterien.
Wiederholte Antibiotikatherapien wirken sich kumulativ auf eine Schädigung der intestinalen Mikrobiota aus und ebnen den Weg bis hin zur Entstehung von chronisch-entzündlichen Darmerkrankungen (M. Crohn, Colitis ulcerosa) [17]. Das Immunsystem des Föten erfährt über mütterliche Bakterien aus der Mündhöhle im Rahmen der Schwangerschaftsgingivitis [49] bereits ein erstes Training, da diese oralen Bakterien auf vaskulärem Weg die Plazenta und ihre Metaboliten den Föten erreichen können.
Geburt
Für die bei der Geburt ausgebildeten Komponenten des Immunsystems stellt diese initiale Kolonisation auch den entscheidenden Stimulus zur weiteren Reifung dar [52], außerdem erfolgt dadurch die erste Besiedlung von Mund, Darm, Haut und Vagina. Dadurch entsteht eine Habitat-spezifische Mikrobiom-Etablierung in den auf die Geburt folgenden Wochen und Monaten [21]. In der Scheide des Neugeborenen führt mütterliches Östrogen während der ersten zwei bis vier Lebenswochen zu einer Reifung des vaginalen Epithels. Dabei führt die Anhäufung von fermentierbarem Glykogen durch die Tätigkeit anaerober Bakterien zu einer Senkung des pH-Werts in der Vagina auf ungefähr fünf [42]. Dieser Effekt ist nur vorübergehend, weil schwindendes mütterliches Östrogen (Halbwertszeit) und dadurch bedingte Verringerung der vaginalen Mukosadicke zu einem Anstieg des pH-Werts führt.
Kindheit
Während der Kindheit wird die Vagina bis zur Pubertät von aeroben, strikt anaeroben und enterischen Bakterien besiedelt, der pH-Wert ist fast im neutralen Bereich [10,] [13], [23].
Pubertät und reproduktive Lebensphase
Mit Beginn der Pubertät verursacht die steigende Östrogenproduktion eine neuerliche Verdickung des vaginalen Epithels [Abb. 2] und Anhäufung von Glykogen (vgl. aber auch [29]). Durch diese veränderten Umweltbedingungen wird die Proliferation von Glykogen-fermentierenden Laktobakterien und die damit einhergehende Ansäuerung des vaginalen Habitats auf pH 3,8–4,4 ermöglicht. Diese Bedingungen bleiben für die ganze reproduktive Lebensphase aufrecht.
Menopause
Nach der Menopause sinken die Östrogenspiegel und die ausbleibende Menstruation führt zu einer Atrophie des vaginalen Epithels. Das wird bei den meisten Frauen begleitet von einem Wechsel der vaginalen Mikrobiota weg von einer Dominanz der Laktat-produzierenden Laktobazillen (sinkendes Angebot an Glykogen; [Abb. 1] hin zu einer Besiedlung mit anaeroben Bakterien; der pH steigt typischerweise auf fast neutrale Bereiche (6,5–7). Dieses Habitat [Abb. 2] ist vergleichbar jenem in der Kindheit – aber auch jenem bei BV.
Schützen und Regenerieren mit Probiotika bei bakterieller Vaginose und vaginaler Dysbiose
Bakterielle Vaginose (BV) ist die häufigste mikrobiologische Veränderung in der Scheide erwachsener Frauen. Die signifikante Reduktion der vaginalen Laktobazillen hat einen Anstieg des pH-Werts (auf über 4,5; vgl. Nugent-Score) und einen Abfall an H2O2 zur Folge, beide Faktoren begünstigen Infektionen.
Studien
In einer doppelblind-randomisierten, placebokontrollierten Studie [18] wurden 60 unter Hormonersatztherapie (HRT) stehende transsexuellen Frauen (male to female) bezüglich der vaginalen Kolonisation mit Laktobazillen untersucht. Ihre dysbiotische vaginale Mikroflora mit nur einer sehr begrenzten Anzahl an Laktobakterien eignet sich natürlich hervorragend für diese Fragestellung. Nach oraler Supplementierung wurde eine signifikant positive Anreicherung mit Laktobazillen in der Verumgruppe festgestellt (6-mal so starke Besiedlung mit Laktobakterien nach oraler Zufuhr im Vergleich zur Placebogruppe) und der Nugent-Score wurde auch hoch signifikant verbessert.
Das regenerative Potenzial von Probiotika bei BV zeigen auch neueste Metaanalysen [15], [26], [27], [35], [45], [46]. Immer wieder wird dabei auf die Wichtigkeit der Zerstörung des Biofilms hingewiesen [3,] [25], damit keine Rezidive [51] entstehen; nach neuen Erkenntnissen beträgt die Rezidivrate nach einer Therapie mit Metronidazol oder Clindamycin bis zu 50 % wenn die Nachbeobachtungszeit auf 6–12 Monate ausgedehnt wird [3]. In Leitlinien [9] findet daher der Wiederaufbau der Scheidenflora mit probiotischen Laktobazillen Eingang: insbesondere nach einer Therapie mit Clindamycin (300 mg 2 × 1 durch 7 Tage), denn dieses bei BV häufig verordnete Antibiotikum zerstört leider auch die normale Scheidenflora [41]. Das ist bei Metronidazol (500 mg 2 × 1 durch 7 Tage oder als Kurzzeitthertapie 1 × 2 g durch 2 Tage [9]) weniger ausgeprägt, dafür zeigt dieses häufig zur Therapie versuchte Antibiotikum aber keine Wirkung bei Atopobium vaginae [41] und wenig Wirkung bei Gardnerella vaginalis [41].
Praxistipps
Die natürliche Besiedlung der Vagina erfolgt (hormonabhängig) über Bakterien aus dem Rektum; Laktobazillen dominieren (bis zu 70 %) das gesunde vaginale Mikrobiom, sie schützen die Vagina indem sie den pH-Wert senken und H2O2 sezernieren.
Eine Behandlung der bakteriellen Vaginose mit Antibiotika (z. B. mit Metronidazol oder Clindamycin) ist wegen des Biofilms oft ineffektiv und Rezidive können auftreten (bis zu 50 % in 6–12 Monaten).
Gardnerella vaginalis und Atopobium vaginae bilden einen Biofilm, in dem sich auch pathogene Bakterien (als „late colonizers“) ansiedeln, dieser Biofilm tritt bei Gesunden nicht auf.
Oral zugeführte probiotische Laktobazillen (L. crispatus, L. gasseri, L. jensenii und L. rhamnosus) bilden im Rektum ein natürliches Reservoir für die Wiederbesiedlung der Vagina, senken in der Scheide den pH-Wert und sezernieren zusätzlich antimikrobielle Substanzen wie H2O2; damit können sie – im Unterschied zu Antibiotika – den Biofilm wie bei Gesunden nachhaltig zerstören.
Eine orale Zufuhr von ausgewählten Laktobazillen entspricht – im Unterschied zu einer lokalen Applikation – der natürlichen Besiedlung, die oral zugeführten Laktobazillen zeigen hohe Adhärenz sowohl in der Scheide als auch im Rektum.
Das wird verständlich, wenn man das Verhalten der frei schwimmenden Bakterienzellen (planctonic cells) von Gardnerella vaginalis und ihr Verhalten in einem Biofilm (in dem andere Ernährungswege existieren) vergleicht. Die Bakterien in der Suspension und im Biofilm verhalten sich nämlich völlig unterschiedlich: Der Biofilm ermöglicht den Bakterien die Anhaftung an der Oberfläche und damit erreichen sie eine wesentlich höhere Konzentrationen als in der luminalen Flüssigkeit. In diesem Biofilm bildet sich dann ein Ökosystem (das braucht Gardnerella vaginalis zum Überleben, weil es ihr Nahrung liefert), in welchem sich dann aber auch pathogene Keime einnisten können. Der Biofilm schützt diese pathogenen Bakterien, die dann als sich nicht vermehrende latente Kolonien in diesem Biofilm wohnen, als Anpassungsmechanismus vor der Einwirkung antimikrobieller Substanzen. Früher dachte man, dass dies primär auf verminderte Penetration in den Biofilm zurückzuführen ist und die Antibiotika die darin lebenden Bakterien nicht erreichen können. Neueste Untersuchungen [11,] [16] haben nun übereinstimmend gezeigt, dass Bakterien im Biofilm aufgrund eines verringerten Sauerstoffgradienten und Nährstoffangebots (z. B. Eisen; vgl. Menstruationsblut) in einer stationären Phase existieren, welche die Wirksamkeit jedes Antibiotikums einschränken, weil der Biofilm in dieser veränderten Bakterienumwelt große Mengen an sog. „Persister-Zellen“ enthält; diese Zellen befinden sich metabolisch in einer „Schlafphase“, sie weisen dadurch eine hohe Antibiotikaresistenz auf und können nach einer Antibiotikatherapie wieder aktiv werden sowie für eine Wiederbesiedlung des Biofilms sorgen. Deshalb wird mit einem Antibiotikum oft nur ein unzureichender Therapieerfolg erzielt und Rezidive entstehen nach kurzer Zeit. Die Wirkung von Antibiotika wird über die Minimale-Hemm-Konzentration erfasst und mit dem Plattendiffusionstest (bzw. E-Test) festgestellt, aber dabei werden die zu prüfendenden Bakterien nicht als Biofilm, sondern in einer Suspension (also in Flüssigkeit aufgeschwemmt) untersucht. Hauptproblem bei der Behandlung einer bakteriellen Vaginose mit Clindamycin oder Metronidazol ist also das Auftreten von Rezidiven [14].
Der entscheidende therapeutische Ansatz liegt daher in der Beseitigung des Biofilms, dessen Bildung Gardnerella vaginalis und Atopobium vaginae begünstigen. Dieser Biofilm kommt bei Gesunden nicht vor.
Therapieansätze
Ziel ist die Wiederherstellung der gesunden, aber verdrängten Laktobazillen-Konzentration in der Scheide. Diese Laktobazillen sezernieren dann wieder ausreichende Mengen an H2O2 um den Biofilm zu beseitigen [50]; diese Regeneration gelingt mit oral verabreichten Probiotika (z. B. einer multi-strain-Kombination aus L. crispatus, L. gasseri, L. jensenii und L. rhamnosus).
Bei Schwangeren mit bakterieller Vaginose ist das Risiko einer Frühgeburt signifikant erhöht, post partum besteht die Gefahr einer Endometritis. Auch hier empfiehlt sich der Einsatz oraler Probiotika. Sogenannte „Hausmittel“ wie Joghurt (lokal angewendet) oder Sitzbäder mit Apfelessig sind im besten Fall nutzlos, aber im schlimmsten Fall schädlich; eine lokale Applikation von Laktobazillen entspricht nicht der natürlichen Besiedlung und ein nötiges Reservoir im Rektum wird damit nicht gebildet. Die bakterielle Vaginose ist oft der Hauptgrund für einen Fluor vaginalis, viele Frauen sind aber symptomlos, obwohl sie die klinischen bzw. labordiagnostischen Kriterien erfüllen. Dies kann darauf zurückgeführt werden, dass nur pathogene Gardnerella vaginalis einen Biofilm ausbildet [12].
Wichtig ist auch darauf hinzuweisen, dass eine übertriebene Intimhygiene das Scheidenmilieu negativ beeinflussen kann. Auch nach jeder Antibiotikatherapie sollen die Folgen auf das Mikrobiom durch den Einsatz spezieller Probiotika ausgeglichen werden [47]. Das ist insbesondere für den Erhalt eines Resevoirs von Laktobazillen im Darm für die Besiedlung der Vagina von entscheidender Bedeutung [37,] [50].
Autor
Gerhard Ernst Steyer
Physiologe und Medizinhistoriker
Literatur
Die Literaturliste finden Sie hier.